 |
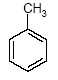
Le Toluène |
Les renseignements donnés ci-après sont la traduction de l'annexe B, consacrée au toluène telle qu'élaborée par l'ATSDR (Agency for toxic substances and desease registry) à l'étude BTEX (B pour benzène, T pour Toluène, E pour Ethylbenzène et X pour Xylènes) publiée par cet organisme américain dans le cadre de sa mission fédérale.(p.111 de l'étude en pdf lue sur Adobe reader et intitulée "DRAFT INTERACTION PROFILE FOR:Benzene, Toluene, Ethylbenzene, and Xylenes (BTEX)
En voici la traduction intégrale: (toutes les indications en italique sont des indications données par le traducteur)
Cette annexe récapitule l'information sur la toxicocinétique, des effets de santé, des mécanismes d'action, et des directives sanitaires à propos du toluène. Les sommaires sont principalement basés sur l'information présentée dans les profils toxicologiques d'ATSDR (2000) pour le toluène et donc ne représentent pas des examens de la littérature sanitaire primaire. La structure chimique pour le toluène est incluse dans l'annexe E.
B.1 Toxicocinétique
Les études sur des humains et des animaux indiquent que le toluène est aisément absorbé par les appareils respiratoires et gastro-intestinaux et, à un moindre degré, par la peau (ATSDR 2000). L'envahissement respiratoire est rapide chez les hommes exposés à une concentration de 80 ppm (parties par millions) du toluène, comme le montrent les concentrations du toluène dans le sang dans un délai de 10-15 minutes d'exposition (Hjelm et autres 1988). Environ 50% du toluène marqué au deutérium a été absorbé par les poumons des volontaires exposés à 53 ppm du toluène pendant deux heures en période d'exercice léger (Lof et autres 1993). Sept humains exposés à une concentration de 50 ppm dans une pièce fermée gardent en moyenne 83 % de la concentration moyenne inspirée (Benoit et autres 1985). Contrôler l'absorption gastro-intestinale chez l'homme est possible en surveillant le toluène dans l'air exhalé et l'urine, pour l'administration par voie orale, par les métabolites du toluène (acide et ortho--crésol hippuric) à la suite d'infusion de 2 mg/minute pendant 3 heures par une sonde d'alimentation dans l'estomac (Baelum et autres 1993). On peut contrôler l'absorption orale du toluène administré à des rats, bien que le taux d'absorption orale ait été plus lent que l'absorption pulmonaire (des niveaux maxima de concentration dans le sang ont été observés pendant 1 heure 30 à-3 heures 15 à 30 minutes après ingestion) (Pyykko et autres 1977). Le taux d'absorption cutanée du toluène liquide par la peau humaine de l'avant-bras s'est avéré lent, s'étendant de 14 à 23 mg/cm2/heure (Dutkiewicz et Tyras 1968). L'absorption cutanée de la vapeur de toluène a été démontrée chez les animaux (ATSDR 2000).Par exemple, augmenter la dose et la durée de l'exposition augmente le taux de toluène dans le corps entier; des niveaux de toluène élevés ont été trouvés chez des souris nues qui ont été exposées à des taux de toluène de 300, 1.000, ou 3.000 ppm alors qu'il n'y avait aucune absorption respiratoire du toluène (Tsuruta 1989). Le coefficient d'absorption par la peau a été calculé à 1.24 cm/heure. Ces taux d'absorption étaient de 0.0009, 0.0046, et 0.0144 mg/cm2/hour pour les concentrations respectives de 300, 1.000 et 3.000 ppm.
La répartition du toluène absorbé par l'homme et des animaux de laboratoire est caractérisée par un stockage préférentiel dans les tissus riches en lipides et fortement vascularisés tels que le cerveau, la moelle, et la graisse du corps (ATSDR 2000). Le toluène se distribue entre le plasma et les globules rouges dans un rapport approximatif de 1:1 chez l'homme selon des données mesurées in vitro et à un rapport de 1:2 chez les rats, données mesurées in vivo (Lam et autres 1990). Dans les globules rouges, le toluène semble être associé à l'hémoglobine plutôt qu'aux membranes de cellules. L'interaction du toluène avec les globules rouges augmente la quantité de toluène qui peut être accepté par le milieu aqueux de sang et facilite le transport du toluène à tous les secteurs du corps (cerveau y compris) à un taux qui est plus élevé que si le toluène était transporté uniquement dans le plasma. Dans le cerveau, le toluène a une plus grande affinité pour les secteurs qui contiennent la matière blanche riche en lipides, telle que les noyaux centraux du cerveau et le cerveau moyen, plutôt que les secteurs comportant de plus grandes quantités de matière grise (Ameno et autres 1992 ; Bergman 1979).
Dans une première étape, le métabolisme du toluène est catalysé par plusieurs espèces du cytochrome P-450 (ATSDR 2000 ; Intestin et autres 1993 ; Nakajima et Wang 1994 ; Nakajima et autres 1991, 199à, 1992b, 1993, 1997 ; Tassaneeyakul et autres 1996). Initialement, la majeure partie du toluène est métabolisée par hydroxylation de chaîne latérale pour former l'alcool benzylique, suivi d'une oxydation en acide benzoïque. L'isozyme principale de CYP impliquée dans la formation de l'alcool benzylique est CYP2E1, bien que puissent l'être également (par ordre décroissant de la métabolisation) les cytochromes CYP2B1, CYP2B6, CYP2C6, CYP1A2, et CYP1A1. La majeure partie de l'acide benzoïque se combine alors avec de la glycine pour former l'acide hippuric, bien que certains combinaisons puissent se faire avec l' uridine-5'-diphosphate (UDP)-glucuronate pour former l'acyle-glucuronide.
Pour les humains et les rats, jusqu' à 75-80% du toluène inhalé qui est absorbé peut être récupéré en tant qu'acide hippuric dans l'urine. La grande partie du toluène restant (20 à 25%) est exhalée sans changement. Une partie très petite (inférieure à une tranche de 1 à 5%) du toluène absorbé subit une hydroxylation d'anneau par CYP1A2, CYP2B2, ou CYP2E1 pour former des intermédiaires 2.3- et 3,4-epoxide et plus tard les ortho- ou para.-crésols, qui sont conjugués avec du sulfate ou du glucuronate (Baelum et autres 1993, Nakajima et Wang 1994 ; Nakajima et autres 1997 ; Tassaneeyakul et autres 1996). D'autres métabolites mineurs incluent de l'acide mercapturic S-benzylique (S-benzyl mercapturic acid) et l'acide S- p-toluylmercapturic (S- p-toluylmercapturic acid), dont on pense qu'ils constituent une série d'étapes débutant par l'alcool benzylique et le 3,4-toluene expoxide, respectivement (Angerer et autres 1998). On s'attend à ce que le foie soit le lieu d'exploitation principal du métabolisme du toluène, en se fondant sur la concentration des isozymes de CYP relativement plus élevée dans le foie comparativement à d'autres tissus. Les études sur le rat indiquent que l'expression des isozymes hépatiques de CYP est influencée par divers facteurs, notamment l'âge, le sexe, et le niveau de l'exposition au toluène (Nakajima et Wang 1994).
Comme indiqué ci-dessus, les études sur des humains et les animaux de laboratoire indiquent qu'après des périodes d'exposition aigûes par inhalation, le toluène absorbé est excrété d'une matière prédominante dans l'urine cependant que des métabolites et, à un moindre degré, le toluène non métabolisé sont exhalés (Lof et autres 1993 ; Ogata 1984 ; Tardif et autres 1998). Par exemple, suivant une exposition de deux heures avec l'exercice physique léger au toluène deutérium-marqué à une concentration de 200 mg/m3 (53 ppm), une moyenne de 78% du toluène marqué a été excrété comme acide hippuric urinaire dans un délai de 20 heures par un groupe de neuf volontaires (Lof et autres 1993). D'autres études estiment qu'une partie significative du toluène absorbé est exhalée comme toluène nonmétabolisé (7-20% du toluène absorbé) (Carlsson 1982 ; Leung et Paustenbach 1988 ; Lof et autres 1993).
Les analyses des données cinétiques pour des concentrations en toluène dans le sang, le souffle expiré, ou les tissus adipeux des humains et des rats après une exposition indiquent que la plupart du toluène absorbé est rapidement éliminé du corps et qu'une plus petite partie (celle qui entre dans les tissus adipeux) est lentement éliminée (Leung et Paustenbach 1988 ; Lof et autres 1993 ; Pellizzari et autres 1992 ; Percer et autres 1996, 1999 ; Rees et autres 1985). Par exemple, avec les modèles de PBPK, les moyennes de vie de 30-38 heures environ ont été calculées pour des changements des concentrations en toluène de sang entre 50 et 100 heures suivant la fin de deux heures d'inhalation par des sujets masculins à la concentration de 50 ppm de H8-toluène (percer et autres 1996, 1999). Durant cette dernière phase, plus de 95% du toluène investissent les tissus adipeux au point que l'extraction du toluène des tissus adipeux a été proposée pour en déterminer le taux limite (percer et autres 1999). L'élimination du toluène oscillant entre 12 et 65 heures dans les échantillons sous-cutanés des tissus adipeux prélevés de 12 sujets dans les 8 jours suivant la cessation d'exposition au toluène à la concentration de quelques de 80 ppm pendant quatre périodes de 30-minutes consécutives, les périodes croissantes d'élimination ont été sensiblement corrélées avec l'augmentation des quantités de graisse du corps (Carlsson et Ljungquist 1982).
Les modèles de PBPK disponibles peuvent décrire la cinétique du toluène après inhalation par l'homme (Fisher et autres 1997 ; Lapare et autres 1993 ; Percer et autres 1996, 1999) et par les rats (DeJongh et Blaauboer 1996, 1997 ; Tardif et autres 1993b).
B.2 Effets sur la santé
Le système nerveux est la cible critique de la toxicité qui suit l'inhalation aiguë, intermédiaire, ou chronique du toluène ou d'une exposition orale à ce produit chimique (ATSDR 2000). Les effets sur le système nerveux humain du toluène sont bien documentés. Les études avec des volontaires dans des conditions aiguës et contrôlées d'exposition (de 6-8 heures) montrent que l'affaiblissement neurologique subtile est discernable sur la plupart des sujets dans la gamme des concentrations de 75-150 ppm (Andersen et autres 1983 ; Baelum et autres 1985 ; Echeverria et autres 1991 ; Guzelian 1988 ; Iregren 1986 ; Rahill et autres 1996). Dans celles des 200-800 ppm les concentrations de ce gaz peuvent produire la joie de vivre et la distraction,(euphorisant) et, aux concentrations aiguës plus élevées, une altération des capacités intellectuelles, psychomotrices et neuromusculaires évidemment suivis d'un état de narcose (EPA 1985 ; von Oettingen et autres 1942). De nombreuses études de cas ont associé à l'inhalation chronique du toluène la narcose et l'euphorie (estimées 4.000-12.000 ppm) et à des dommages neurologiques résiduels ou permanents comme le démontrent des électroencéphalogrammes anormaux, des changements structurels du cerveau, des tremblements, la psychose paranoïde, les hallucinations récurrentes, et le discours, l'audition, et la vision altérés (ATSDR 2000).Des études menées sur des ouvriers exposés fréquemment à des pollutions de l'air au toluène sur les lieux de travail à des concentrations s'échelonnant de 30 à 150 ppm ont démontré la plus grande incidence de ce gaz sur des symptômes neurologiques individuels rapportant des déficits neuro-comportementaux, la perte d'audition, des difficultés de perception de champs visuels, l'affaiblissement du potentiel du cerveau et l'affaiblissement de la vision des couleurs.
Les informations sur les effets neurologiques du toluène proviennent d' études sur son inhalation par des animaux. Elle montrent des changements du comportement, la perte d'audition, et des changements subtiles de la structure du cerveau, de l'électrophysiologie, au niveau des neurotransmetteurs du cerveau (ATSDR 2000). Par exemple, des baisses de performances dans des réponses neuromusculaires typiques se sont produites en exposant des rats à des concentrations du toluène aussi basses que 125 ppm pendant 4 heures (Kishi et autres 1988 ; Mullin et Krivanek 1982 ; Wood et autres 1983), des changements de variables biochimiques de cerveau (par exemple, sur les niveaux de dopamine, sur les liaisons des récepteurs D2 de la dopamine, changements de protéine de l' acide fibrillaire glial (Depuis le décodage du génome humain, "glial fibrillary acidic protein" est désormais une désignation obsolète, à remplacer par le gène suivant: 'type III intermediate filament ; GO:0045098'. Ce gène apparait dans la maladie d'Alzheimer manifestement liée à l'envahissement de notre atmosphère par des gaz qui en assurent la promotion) ont été provoqués chez les rats exposés aux concentrations aussi basses que 50-80 ppm pour 6-8 heures/jour (api 1997 ; Hillefors-Bergllund et autres 1995 ; Ikeda et autres 1986 ; Little et autres 1998 ; von Euler et autres 1989, 1993, 1994), perte d'audition se produisant chez des rats exposés aux concentrations de 700 à 1.000 ppm, 6 à 14 heures par jour pendant deux à neuf semaines (Campo et autres 1997, 1998 ; Johnson et autres 1988 ; Pryor et Rebert 1992 ; Pryor et autres 198â, 1984b, 1991), et diminutions de poids de cerveau et de contenu en phospholipide se produisent chez les rats exposés sans interruption à 320 ppm pendant 30 jours (Kyrklund et autres 1987).
Des effets neurologiques sont observés chez les animaux après exposition orale aigue ou de durée intermédiaire provoquant des "flashes" sur des rats gavés par sondes gastriques au toluène à la concentration faible de 250 mg/kg (Dyer et autres 1988), ainsi que des modifications dans le cerveau de l'intensité de plusieurs neurotransmetteurs (par exemple, nopépinéphrine, dopamine, sérotonine) chez des souris buvant de l'eau additionnée de 5 à 105 mg/kg/jour du toluène pendant 28 jours (Hsieh et autres 1990).
Le toluène provoque l'irritation du système respiratoire de l'homme après inhalation aigue aux concentrations dépassant approximativement 100 ppm, mais il n'est pas évident qu'il ait d'autres effets nuisibles (ATSDR 2000). Les études sur l'exposition chronique au toluène ou des humains professionnellement exposés ont fourni peu de preuves de dommages sérieux provoqués sur le foie par l'inhalation de toluène. Ont été observées des augmentations pondérales du foie (probablement due à l'induction enzymatique microsomique), mais sans changement histologique hépatique crucial, en conséquence consécutives d'expositions aiguës, intermédiaires, ou chroniques de rats et de souris aux concentrations dépassant 300 ppm (ATSDR 2000).
Le rein peut être une cible pour la toxicité du toluène après exposition à des niveaux très élevés. L'acidose rénale a été observée dans des cas d'expositions abusives au toluène, mais le disfonctionnement rénal s'est généralement inversé quand l'exposition a cessé, et les cas dans lesquels cela s'est produit ont été fréquemment confondus avec des expositions probables à de multiples dissolvants (ATSDR 2000).
Des dommages au rein (par exemple, fontes tubulaires rénales) ont été provoqués sur des rats après leur exposition pour des durées intermédiaires et chroniques aux concentrations dépassant 600 ppm (CIIT 1980 ; NTP 1990).
A l'évidence, le toluène peut poser quelques problèmes en matière de reproduction, particulièrement après inhalation répétée pendant la grossesse aux concentrations au-dessus de 200 ppm (ATSDR 2000). On a observé les plus grands risques d'avortements spontanés chez les femmes professionnellement exposées au toluène, ou aux épouses des hommes pareillement exposés (Lindbohm et autres 1992 ; Ng et autres 1992 ; Taskinen et autres 1989).
Cependant, l'interprétation de ces résultats est limitée par la petite dimension de l'échantillon analysé, par l' impossibilité de mesurer des niveaux d'exposition précis, ou celle d'expliquer toutes les variables possibles impliquées, et par la difficulté de valider les données médicales individuelles rapportées. L'exposition professionnelle à des concentrations croissantes de toluène (8 à 111 ppm) a été associée à des diminutions dans le plasma des hormones luteinizing, et de follicule et à des niveaux stimulants de testostérone chez les mâles (Svensson et autres 199à, 1992b).
Les études sur les animaux ont révélés quelques changements provoqués par le toluène sur les organes reproducteurs mâles et femelles (par exemple, diminution du sperme des rats mâles [ Ono et autres 1995, 1996 ] et modifications d'ultrastructure des follicules antrales des ovaires de rats femelles [ robinet et autres 1996 ]), mais sans établir d'évidence histologique quant l'existence de dommages structuraux sur des organes reproducteurs des rats et souris exposés oralement pour des durées intermédiaires ou chroniques par inhalation (NTP 1990). Aucune preuve d'altération des fonctions reproductrices n'a été trouvée dans diverses analyses (Ono et autres 1995, 1996 ; Smith 1983 ; Thiel et Chahoud 1997), y compris par une étude exposant, par intermittence et jusqu'à la concentration de 2000 ppm, deux générations de rats (api 1985), bien que l'exposition contrôlée au toluène ait augmenté la mortalité foetale chez ces rats (Ono et autres 1995, 1996), et accru le nombre des avortements spontanés chez des lapins exposés sans interruption exposés à 267 ppm de toluène au lieu de 133 ppm (Ungvary et Tatrai 1985).
Les résultats de plusieurs études d'exposition d'animaux par inhalation indiquent que cette exposition aux concentrations du toluène qui commencent à produire la toxicité maternelle peut causer des effets foetaux, y compris la survie et le retardement foetaux, retards de la croissance et du développement squelettique (Courtney et autres 1986 ; Hudak et Ungvary 1978 ; Centre 199à, 1992b De Recherches De Huntingdon ; Ono et autres 1995 ; Thiel et Chahoud 1997 ; Ungvary et Tatrai 1985).
Le cerveau humain |
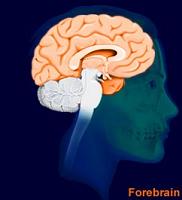 |
La partie antérieure et la plus large du cerveau comprend : les hémisphères, le système ventriculaire (limbic), les thalamus et hypothalamus, et les corps cailleux ou granuleux Chaque hémisphère est divisé en quatre lobes: frontal , pariétal, occipital et temporal. Collectivement les fonctions de la partie antérieure la plus large du cerveau sont de contrôler les fonctions cognitives, sensorielles et motrices, de réguler la température, les fonctions de reproduction, de s'alimenter, de dormir et de dispenser les émotions. |
Les études sur les humains et les animaux et ne soutiennent généralement pas un risque de cancérogénicité du toluène. Onze études d'épidémiologie humaine ont évalué l'exposition au toluène comme facteur de risque possible pour le cancer (ATSDR 2000).(Comme il s'agit d'un solvant des PAH, des PCB et des insecticides, le risque de libération de métabolites stationnant dans les graisses est élevé.) La plupart des cancers typés n'ont pas été significativement associés à l'exposition au toluène dans les études et il y avait peu de chances que leurs résultats puissent associer un type particulier de cancer avec l'exposition au toluène.
Trois études statistiques ont étudié le cas d'ouvriers principalement et professionnellement exposés au toluène, le reste de la cohorte statistique impliquant principalement des personnes exposées à des mélanges de solvants incluant le toluène (Antilla et autres 1998 ; ATSDR 2000 ; Svensson et autres 1990 ; Walker et autres 1993). L'approfondissement des études sur l'homme est insuffisant pour évaluer le pouvoir cancérogène du toluène, principalement faute de résultats et à la probabilité que plusieurs des groupes étudiés ont été exposés à des produits chimiques multiples.
Les essais biologiques chroniques sur les rats et les souris pas trouvé de relations entre les doses d'exposition orales ou inhalées et des néoplasies dans les tissus qui en seraient les conséquences (CIIT 1980 ; Maltoni et autres 1997 ; NTP 1990). Le toluène s'est généralement révélé nongenotoxic (sauf au niveau du cerveau!) dans des études in vivo sur des humains exposés, les analyses microbiennes in vitro et autres systèmes d'essai (ATSDR 2000).
B.3 - Mécanismes d'action
Généralement, le mécanisme par lequel une exposition aiguë au toluène provoque des effets neurologiques, tels que la dépression et la narcose du système nerveux central, parait impliquer, au moins en partie, des interactions réversibles entre le toluène (le composé et non ses métabolites) et des composants (des lipides ou des protéines) des membranes du système nerveux (ATSDR 2000). L'élément matériel fondant l'action pathologique vient de l'observation que le prétraitement des rats au phénobarbital augmente le taux de métabolisme in vivo du toluène et raccourcit la période du rétablissement de la narcose des doses intrapéritonéales simples de toluène (Ikeda et Ohtsuji 1971). L'autre point de vue soutenant cette hypothèse inclut la nature passagère de l'anesthésie, qui peut être mesurée, suite à une exposition aiguë de niveau élevé au toluène (Korpela et Tahti 1988 ; Lebel et Schatz 1988, 1989, 1990 ; Rea et autres 1984). Au niveau moléculaire, les actions anesthésiques aiguës du toluène et d'autres agents ont été supputées pour expliquer l'intercalation de toluène entre les deux couches de lipide des membranes nerveuses et/ou des interactions réversibles des protéines dans la membrane elle-même (contreseings et Lieb 1985, 1987).On a observé cliniquement la dégradation neurologique (par exemple, démarche et anomalies de la parole) et atrophie de cerveau dans plusieurs cas d'excessive inhalation chronique de toluène. Les changements observés en imageries (MRI: magetic resonance imagery) du cerveau peuvent être en relation avec la composition des lipides dans la matière blanche (Filley et autres 1990 ; Rosenberg et autres 1988a, 1988b) suggèrent l'atrophie préférentielle dans des régions plus riches en lipides du cerveau (ATSDR 2000). Les modications visibles sur MRI peuvent être liées aux changements de la composition des lipides de la matière blanche, puisque ces régions sont plus riches en lipides que la matière grise (Ameno et autres 1992).
L'hyppocampus |
 |
A structure found in the temporal of the forebrain. The hippocampus is a component of the limbic system and is important in the formation of memories and other higher functions. |
ATSDR (2000) a défini un MRL par ingestion orale de toluène de 0.8 mg/kg fondé sur un LOAEL (lowest-observed-adverse-effect level ou niveau d'effet négatif le plus bas observé) de 250 mg/kg/jour avec des effets neurologiques (potentiel flash diminué) chez les rats (Dyer et autres 1988) et un facteur d'incertitude de 300 (3 pour l'usage d'un LOAEL minimal, 10 pour l'extrapolation des animaux aux humains, et 10 pour la variabilité humaine). Les animaux ont été gavés d'une dose simple de toluène par sonde gastrique.
ATSDR (2000) a déterminé un MRL de durée intermédiaire par ingestion orale de 0.02 mg/kg/jour de toluène fondé sur un LOAEL de 5 mg/kg/jour pour des effets neurologiques (le cerveau [régional?] augmente en neurotransmetteurs de monoamine) chez les souris (Hsieh et autres 1990) et un facteur d'incertitude de 300 (3 pour l'usage d'un LOAEL minimal, 10 pour l'extrapolation des animaux aux humains, et 10 pour la variabilité humaine). Les animaux ont été absorbés le toluène dans l'eau potable pendant 28 jours.
Faute de données appropriées, ATSDR (2000) n'a pas défini de MRL pour l'absorption orale chronique de toluène:
- La base de données d'IRIS d'EPA énumère un RfD (reference dose) et un RfC (reference concentration) pour le toluène (IRIS 2001). Le RfD est basé sur un NOAEL de 312 mg/kg/day (convertis en 223 mg/kg/jour) pour des changements de poids de foie et des reins chez les rats (NTP 1990) et un facteur d'incertitude de 1.000 (appliqué pour expliquer des extrapolations des inter et intra espèces, pour l'extrapolation, et pour des données reproductrices et développementales limitées de toxicité). Les animaux ont absorbé par sonde gastrique le toluène dissous dans de l'huile de maïs 5 jours par semaines pendant 13 semaines.
- Dans ce cas, le RfC d'EPA pour le toluène est basé sur un LOAEL de 88 pour des effets neurologiques chez l'homme (Foo et autres 1990) et un facteur d'incertitude de 300 (10 pour l'usage d'un LOAEL, 10 pour la variabilité humaine, et 3 pour insuffisances de base de données) (IRIS 2001). Des ouvriers avaient été professionnellement exposés au toluène pendant 5 à 7 ans en moyenne.
Le NTP (2001) n'a pas listé le toluène comme carcinogène humain connu ou suspect. EPA a déterminé que le toluène n'est pas classable quant à la cancérogénicité (catégorie D), décision fondée sur aucune donnée humaine et animales satisfaisantes (IRIS 2001). IARC (1999a) estime que le toluène n'est pas classable quant à sa cancérogénicité (groupe 3) pour les humains en se fondant sur une absence d'évidence satisfaisante et l'absence de cancérogénécité chez les animaux.
B.5 References Abbate C, Garganey C, Munao F, et al. 1993. Neurotoxicity induced by exposure to toluene. An electrophysiologic study. Int Arch Occup Environ Health 64:389-392. (As cited in ATSDR 2000.)
ACGIH. 2001. Threshold limit values for chemical substances and physical agents and biological exposure indices. Cincinnati, OH: American Conference of Governmental Industrial Hygienists.
Ameno K, Kiriu T, Fuke C, et al. 1992. Regional brain distribution of toluene in rats and in human autopsy. Arch Toxicol 66:153-156. (As cited in ATSDR 2000.)
Andersen I, Lundqvist GR, Molhave L, et al. 1983. Human response to controlled levels of toluene in six-hour exposures. Scand J Work Environ Health 9:405-418. (As cited in ATSDR 2000.)
Angerer J, Schildbach M, Kramer A. 1998. S-p-toluylmercapturic acid in the urine of workers exposed to toluene: A new biomarker for toluene exposure. Arch Toxicol 72(2):119-23. (As cited in ATSDR 2000.)
Antilla A, Pukkala E, Riala R, et al. 1998. Cancer incidence among Finnish workers exposed to aromatic hydrocarbons. Int Arch Occup Environ Health 71:187-193. (As cited in ATSDR 2000.)
API. 1985. Two-generation reproduction/fertility study on a petroleum-derived hydrocarbon (toluene) Vol. 1. Washington, DC: American Petroleum Institute. (As cited in ATSDR 2000.)
API. 1997. Brain glial fibrillary acidic protein (GFAP) as a marker of neurotoxicity during inhalation exposure to toluene. Washington, DC: American Petroleum Institute. API Publication Number 4647.(As cited in ATSDR 2000.)
ATSDR. 2000. Toxicological profile for toluene. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry.
Baelum J, Andersen I, Lundqvist GR, et al. 1985. Response of solvent-exposed printers and unexposed controls to six-hour toluene exposure. Scand J Work Environ Health 11:271-280. (As cited in ATSDR 2000.)
Baelum J, Molhave L, Honore Hansen S, et al. 1993. Hepatic metabolism of toluene after gastrointestinal uptake in humans. Scand J Work Environ Health 19(1):55-62. (As cited in ATSDR 2000.)
Benoit FM, Davidson WR, Lovett AM, et al. 1985. Breath analysis by API/MS human exposure to volatile organic solvents. Int Arch Occup Environ Health 55:113-120. (As cited in ATSDR 2000.)
Bergman K. 1979. Application and results of whole-body autoradiography in distribution studies of organic solvents. CRC Crit Rev Toxicol 12(1):59-118. (As cited in ATSDR 2000.)
Boey KW, Foo SC, Jeyaratnam J. 1997. Effects of occupational exposure to toluene: A neuropsychological study on workers in Singapore. Ann Acad Med Singapore 26(2):84-7. (As cited in ATSDR 2000.)
Campo P, Lataye R, Cossec B, et al. 1997. Toluene-induced hearing loss: A mid-frequency location of the cochlear lesions. Neurotoxicol Teratol 19(2):129-40. (As cited in ATSDR 2000.)
Campo P, Lataye R, Cossec B, et al. 1998. Combined effects of simultaneous exposure to toluene and ethanol on auditory function in rats. Neurotoxicol Teratol 20(3):321-332. (As cited in ATSDR 2000.)
Carlsson A. 1982. Exposure to toluene: Uptake, distribution and elimination in man. Scand J Work Environ Health 8:43-55. (As cited in ATSDR 2000.)
Carlsson A, Ljungquist E. 1982. Exposure to toluene: Concentration in subcutaneous adipose tissue. Scand J Work Environ Health 8:56-62. (As cited in ATSDR 2000.)
CIIT. 1980. A 24 month inhalation toxicology study in Fischer-344 rat exposed to atmospheric toluene. Executive Summary and Data Tables. Research Triangle Park, NC: Chemical Industry Institute of Toxicology. October 15, 1980. (As cited in ATSDR 2000.)
Courtney KD, Andrews JE, Springer J, et al. 1986. A perinatal study of toluene in CD-1 mice. Fundam Appl Toxicol 6:145-154. (As cited in ATSDR 2000.)
DeJongh J, Blaauboer BJ. 1996. Simulation of toluene kinetics in the rat by a physiologically based pharmacokinetic model with application of biotransformation parameters derived independently in vitro and in vivo. Fund Appl Toxicol 32(2):260-8. (As cited in ATSDR 2000.)
DeJongh J, Blaauboer BJ. 1997. Evaluation of in vitro-based simulations of toluene uptake and metabolism in rats. Toxicol in Vitro 11:485-489. (As cited in ATSDR 2000.)
Dutkiewicz T, Tyras H. 1968. Skin absorption of toluene, styrene and xylene by man. Br J Ind Med 25:243. (As cited in ATSDR 2000.)
Dyer RS, Bercegeay MS, Mayo LM. 1988. Acute exposures to p-xylene and toluene alter visual information processing. Neurotoxicol Teratol 10:147-153. (As cited in ATSDR 2000.)
Echeverria D, Fine L, Langolf G, et al. 1991. Acute behavioural effects of toluene and ethanol in human subjects. Br J Ind Med 48:750-761. (As cited in ATSDR 2000.)
EPA. 1985. Drinking water criteria document for toluene. Washington, DC: U.S. Environmental Protection Agency, Office of Drinking Water. ECAO-CIN-408. EPA 600/x-84-188. PB 86-117975. (As cited in ATSDR 2000.)
Filley CM, Heaton RK, Rosenberg NL. 1990. White matter dementia in chronic toluene abuse. Neurology 40:532-534. (As cited in ATSDR 2000.)
Fischer J, Mahle D, Bankston L, et al. 1997. Lactational transfer of volatile chemicals in breast milk. Am Ind Hyg Assoc J 58(6):425-431.(As cited in ATSDR 2000.)
Foo SC, Jeyaratnam J, Koh D. 1990. Chronic neurobehavioural effects of toluene. Br J Ind Med 47:480- 484. (As cited in ATSDR 2000.)
Franks NP, Lieb WR. 1985. Mapping of general anaesthetic target sites provides a molecular basis for cutoff effects. Nature 316: 349-351.
Franks NP, Lieb WR. 1987. Anaesthetics on the mind. Nature 328:113-114.
Gospe SM, Zhou SS. 1998. Toluene abuse embryopathy: Longitudinal neurodevelopment effects of prenatal exposure to toluene in rats. Reprod Toxicol 12(2):119-126. (As cited in ATSDR 2000.)
Gospe SM Jr, Zhou SS, Saeed DB et al. 1996. Development of a rat model of toluene-abuse embryopathy. Pediatr Res 40(1):82-87. (As cited in ATSDR 2000.)
Gut I, Terelius Y, Frantík E, et al. 1993. Exposure to various benzene derivatives differently induces cytochromes P450 2B1 and P450 2E1 in rat liver. Arch Toxicol 67:237-243.
Guzelian P, Mills S, Fallon HJ. 1988. Liver structure and function in print workers exposed to toluene. J Occup Med 30(10):791-796. (As cited in ATSDR 2000.)
Hillefors-Berglund M, Liu Y, von Euler G. 1995. Persistent, specific and dose-dependent effects of toluene exposure on dopamine D2 agonist binding in the rat caudate-putamen. Toxicology 100:185-94. (As cited in ATSDR 2000.)
Hjelm EW, Naslund PH, Wallen M. 1988. Influence of cigarette smoking on the toxicokinetics of toluene in humans. J Toxicol Environ Health 25:155-163. (As cited in ATSDR 2000.)
Hsieh GC, Sharma RP, Parker RD, et al. 1990. Evaluation of toluene exposure via drinking water on levels of regional brain biogenic monoamines and their metabolites in CD-1 mice. Ecotoxicol Environ Saf 20:175-184. (As cited in ATSDR 2000.)
Hudak A, Ungvary G. 1978. Embryotoxic effects of benzene and its methyl derivatives: Toluene, xylene. Toxicology 11:55-63. (As cited in ATSDR 2000.)
Huntingdon Research Centre. 1992a. A preliminary study of the effect of toluene on pregnancy of the rat (inhalation exposure). Huntingdon, Cambridgeshire , England: Huntingdon Research Centre, Ltd. APT 1/91309. (As cited in ATSDR 2000.)
Huntingdon Research Centre. 1992b. Toluene: Effect on pregnancy of the rat by inhalation (status report). Huntingdon, Cambridgeshire, England: Huntingdon Research Centre, Ltd. APT 2/91279. (As cited in ATSDR 2000.)
IARC. 1999a. IARC monographs on the evaluation of carcinogenic risks to humans: Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. Volume 71. Part 2. Lyon, France: World Health Organization, International Agency for Research on Cancer, 829-864.
Ikeda M, Ohtsuji H. 1971. Phenobarbital-induced protection against toxicity of toluene and benzene in the rat. Toxicol Appl Pharmacol 20:30-43. (As cited in ATSDR 2000.)
Ikeda M, Koizumi A, Kasahara M, et al. 1986. Combined effects of n-hexane and toluene on norepinephrine and dopamine levels in rat brain tissues after long-term exposure. Bull Environ Contam Toxicol 36:510-517. (As cited in ATSDR 2000.)
Iregren A. 1986. Subjective and objective signs of organic solvent toxicity among occupationally exposed workers. Scand J Work Environ Health 12:469-475. (As cited in ATSDR 2000.)
IRIS. 2001. Toluene. Integrated Risk Information System, U.S. Environmental Protection Agency. http//:www.epa.gov/iris/subst/0118.htm.
Johnson AC, Juntunen L, Nylen P, et al. 1988. Effect of interaction between noise and toluene on auditory function in the rat. Acta Otolaryngol 101:56-63. (As cited in ATSDR 2000.)
Jones HE, Balster RL. 1997. Neurobehavioral consequences of intermittent prenatal exposure to high concentrations of toluene. Neurotoxicol Teratol 19(4):305-313. (As cited in ATSDR 2000.)
Kishi R, Harabuchi I, Ikeda T, et al. 1988. Neurobehavioral effects and pharmacokinetics of toluene in rats and their relevance to man. Br J Ind Med 45:396-408. (As cited in ATSDR 2000.)
Korbo L, Ladefoged O, Lam HR, et al. 1996. Neuronal loss in hippocampus in rats exposed to toluene. Neurotoxicology 17(2):359-66. (As cited in ATSDR 2000.)
Korpela M, Tahti H. 1988. The effect of in vitro and in vivo toluene exposure on rat erythrocyte and synaptosome membrane integral enzymes. Pharmcol Toxicol 63:30-32. (As cited in ATSDR 2000.)
Kostas J, Hotchin J. 1981. Behavioral effects of low-level perinatal exposure to toluene in mice. Neurobehav Toxicol Teratol 3:467-469. (As cited in ATSDR 2000.)
Kyrklund T, Kjellstrand P, Haglid K. 1987. Brain lipid changes in rats exposed to xylene and toluene. Toxicology 5:123-133. (As cited in ATSDR 2000.)
Lam CW, Galen TJ, Boyd JF, et al. 1990. Mechanism of transport and distribution of organic solvents in blood. Toxicol Appl Pharmacol 104:117-129. (As cited in ATSDR 2000.)
Lapare S, Tardif R, Brodeur J. 1993. Effect of various exposure scenarios on the biological monitoring of organic solvents in alveolar air: I. Toluene and m-xylene. Int Arch Occup Environ Health 64(8):569-80.
LeBel CP, Schatz RA. 1988. Toluene-induced alterations in rat synaptosomal membrane composition and function. J Biochem Toxicol 3:279-293. (As cited in ATSDR 2000.)
LeBel CP, Schatz RA. 1989. Effect of toluene on rat synapsomal phospholipid methylation and membrane fluidity. Biochem Pharmacol 38(22):4005-4011. (As cited in ATSDR 2000.)
LeBel CP, Schatz RA. 1990. Altered synaptosomal phospholipid metabolism after toluene: Possible relationship with membrane fluidity, Na+, K+-adewnosine triphosphatase and phospholipid methylation. J Pharmacol Exp Ther 253(3):1189-1197. (As cited in ATSDR 2000.)
Leung H-W, Paustenbach DJ. 1988. Application of pharmacokinetics to derive biological exposure indexes from threshold limit values. Am Ind Hyg Assoc J 49(9):445-450. (As cited in ATSDR 2000.)
Lindbohm L, Taskinen H, Kyyronen P, et al. 1992. Effects of parental occupational exposure to solvents and lead on spontaneous abortion. Scand J Work Environ J Health 18:37-39. (As cited in ATSDR 2000.)
Little AR, Gong Z, Singh U, et al. 1998. Decreases in brain glial fibrillary acidic protein (GFAP) are associated with increased serum corticosterone following inhalation exposure to toluene. Neurotoxicology 19(4-5):739-748. (As cited in ATSDR 2000.)
Lof A, Hjelm EW, Colmsjo A, et al. 1993. Toxicokinetics of toluene and urinary excretion of hippuric acid after human exposure to 2H8-toluene. Br J Ind Med 50:55-59. (As cited in ATSDR 2000.)
Maltoni C, Ciliberti A, Pinto C, et al. 1997. Results of long-term experimental carcinogenicity studies of the effects of gasoline, correlated fuels, and major gasoline aromatics on rats. Ann N Y Acad Sci 837:15- 52. (As cited in ATSDR 2000.)
Morata TC, Fiorini AC, Fischer FM, et al. 1997. Toluene-induced hearing loss among rotogravure printing workers. Scand J Work Environ Health 23(4): 289-98. (As cited in ATSDR 2000.)
Mullin LS, Krivanek ND. 1982. Comparison of unconditioned reflex and conditioned avoidance tests in rats exposed by inhalation to carbon monoxide, 1,1,1-trichloroethane, toluene or ethanol. Neurotoxicology 3:126-137. (As cited in ATSDR 2000.)
Nakajima T, Wang RS. 1994. Induction of cytochrome P450 by toluene. Int J Biochem 12:1333-1340. Nakajima T, Wang R-S, Elovaara E, et al. 1991. Monoclonal antibody-directed characterization of cytochrome P-450 isozymes responsible for toluene metabolism in rat liver. Biochem Pharmacol 41(3):395-404. (As cited in ATSDR 2000.)
Nakajima T, Wang R-S, Elovaara E, et al. 1992a. A comparative study on the contribution of cytochrome P450 isozymes to metabolism of benzene, toluene and trichloroethylene in rat liver. Biochem Pharmacol 43:251-257.
Nakajima T, Wang R-S, Elovaara E, et al. 1993. Cytochrome P450-related differences between rats and mice in the metabolism of benzene, toluene and trichloroethylene in liver microsomes. Biochem Pharmacol 45(5):1079-1085.
Nakajima T, Wang R-S, Elovaara E, et al. 1997. Toluene metabolism by cDNA-expressed human hepatic cytochrome P-450. Biochemical Pharmacology 53(3):271-277. (As cited in ATSDR 2000.)
Nakajima T, Wang R-S, Katakura Y, et al. 1992b. Sex-, age- and pregnancy-induced changes in the metabolism of toluene and trichloroethylene in rat liver in relation to the regulation of cytochrome P45011E1 and P45011C11 content. J Pharmacol Exp Ther 261(3):869-874. (As cited in ATSDR 2000.)
Ng TP, Foo SC, Yoong T. 1992. Risk of spontaneous abortion in workers exposed to toluene. Br J Ind Med 49:804-808. (As cited in ATSDR 2000.)
NTP. 1990. National Toxicology Program technical report series toxicology and carcinogenesis studies of toluene (CAS No. 108-88-3) in F344/N rats and B6C3F mice (inhalation studies). Research Triangle Park, NC: U.S. Environmental Protection Agency, Department of Health and Human Services. No. 371. PB90-256371. (As cited in ATSDR 2000.)
NTP. 2001. Ninth report on carcinogens. U.S. Department of Health and Human Services, Public Health Service, National Toxicology Program. http://ehis.niehs.nih.gov/roc/toc9.html. June 2001. Ogata M. 1984. Estimation of solvent concentrations in ambient air from urinary metabolite levels of workers exposed to solvents. Ind Health 22:319-324. (As cited in ATSDR 2000.)
Ono A, Sekita K, Ogawa Y, et al. 1996. Reproductive and developmental toxicity studies of toluene: II. Effects of inhalation exposure on fertility rats. J Environ Pathol Toxicol Oncol 15(1):9-20. (As cited in ATSDR 2000.)
Ono A, Sekita K, Ohno K, et al. 1995. Reproductive and developmental toxicity studies of toluene: I. Teratogenicity study of inhalation exposure in pregnant rats. J Toxicol Sci 20(2):109-34. (As cited in ATSDR 2000.)
Orbaek P, Nise G. 1989. Neurasthenic complaints and psychometric function of toluene-exposed rotogravure printers. Am J Ind Med 16:67-77. (As cited in ATSDR 2000.)
Pierce CH, Dills RL, Morgan MS, et al. 1996. Interindividual differences in 2H8-toluene toxicokinetics assessed by semi-empirical physiologically based model. Toxicol Appl Pharmacol 139(1):49-61. (As cited in ATSDR 2000.)
Pierce CH, Lewandowski TA, Dills RL, et al. 1999. A comparison of 1H8-toluene toxicokinetics in men. Xenobiotica 29(1):93-108. (As cited in ATSDR 2000.)
Pellizzari ED, Wallace LA, Gordon SM. 1992. Elimination kinetics of volatile organics in humans using breath measurements. J Expo Anal Environ Epidemiol 2(3):341-55. (As cited in ATSDR 2000.)
Pryor GT, Rebert CS. 1992. Interactive effects of toluene and hexane on behavior and neurophysiologic responses in Fischer-344 rats. Neurotoxicology 13:225-234. (As cited in ATSDR 2000.)
Pryor GT, Dickinson J, Feeney E, et al. 1984a. Hearing loss in rats first exposed to toluene as weanlings or as young adults. Neurobehav Toxicol Teratol 6:223-238. (As cited in ATSDR 2000.)
Pryor GT, Rebert CS, Dickinson J, et al. 1984b. Factors affecting toluene-induced ototoxicity in rats. Neurobehav Toxicol Teratol 6:223-238. (As cited in ATSDR 2000.)
Pryor GT, Rebert CS, Kassay K, et al. 1991. The hearing loss associated with exposure to toluene is not caused by metabolite. Brain Res Bull 27:109-113. (As cited in ATSDR 2000.)
Pyykko K, Tahti H, Vapaatalo H. 1977. Toluene concentrations in various tissues of rats after inhalation and oral administration. Arch Toxicol 38:169-176. (As cited in ATSDR 2000.)
Rahill AA, Weiss B, Morrow PE, et al. 1996. Human performance during exposure to toluene. Aviat Space Environ Med 67(7):640-7. (As cited in ATSDR 2000.)
Rea TM, Nash JF, Zabik JE, et al. 1984. Effects of toluene inhalation on brain biogenic amines in the rat. Toxicology 31:143-150. (As cited in ATSDR 2000.)
Rees DC, Wood RW, McMormick JP, et al. 1985. Toxicokinetics of toluene in the rat. Scand J Work Environ Health 11:301-306. (As cited in ATSDR 2000.)
Rosenberg NL, Kleinschmidt-Demasters BK, Davis KA, et al. 1988a. Toluene abuse causes diffuse central nervous system white matter changes. Ann Neurol 23(6):611-614. (As cited in ATSDR 2000.)
Rosenberg NL, Spitz MC, Filley CM, et al. 1988b. Central nervous system effects of chronic toluene abuse clinical, brainstem evoked response and magnetic resonance imaging studies. Neurotoxicol Teratol 10:489-495. (As cited in ATSDR 2000.)
Seidenberg JM, Anderson DG, Becker RA. 1986. Validation of an in vivo developmental toxicity screen in the mouse. Teratogenesis Carcinogen Mutagen 6:361-374. (As cited in ATSDR 2000.)
Smith KN. 1983. Determination of the reproductive effects in mice of nine selected chemicals. Bioassay Systems Corporation. NIOSH Contract No. 210-81-6011. BSC Project No. 10867. (As cited in ATSDR 2000.)
Svensson B-G, Nise G, Englander V, et al. 1990. Deaths and tumours among rotogravure printers exposed to toluene. Br J Ind Med 47:372-379. (As cited in ATSDR 2000.)
Svensson B-G, Nise G, Erfurth EM, et al. 1992a. Hormone status in occupational toluene exposure. Am J Ind Med 22:99-107. (As cited in ATSDR 2000.)
Svensson B-G, Nise G, Erfurth EM, et al. 1992b. Neuroendocrine effects in printing workers exposed to toluene. Br J Ind Med 49:402-408. (As cited in ATSDR 2000.)
Tap O, Solmaz S, Polat S, et al. 1996. The effect of toluene on the rat ovary: An ultrastructural study. J Submicrosc Cytol Pathol 28(4):553-8. (As cited in ATSDR 2000.)
Tardif R, Lapare S, Krishnan K, et al. 1993b. Physiologically based modeling of the toxicokinetic interaction between toluene and m-xylene in the rat. Toxicol Appl Pharmacol 120:266-273. (As cited in ATSDR 2000.)
Tardif R, Truchon G, Brodeur J. 1998. Comparison of hippuric acid and o-cresol in urine and unchanged toluene in alveolar air for the biological monitoring of exposure to toluene in human volunteers. Appl Occup Environ Hyg 13(2):127-132.
Taskinen H, Anttila A, Lindbohm L, et al. 1989. Spontaneous abortions and congenital malformations among the wives of men occupationally exposed to organic solvents. Scand J Work Environ Health 15:345-352. (As cited in ATSDR 2000.)
Tassaneeyakul W, Birkett DJ, Edwards JW, et al. 1996. Human cytochrome P450 isoform specificity in the regioselective metabolism of toluene and o-, and p-xylene. J Pharmacol Exp Ther 276(1):101-108. Thiel R, Chahoud I. 1997. Postnatal development and behaviour of Wistar rats after prenatal toluene exposure. Arch Toxicol 71(4):258-65. (As cited in ATSDR 2000.)
Tsuruta H. 1989. Skin absorption of organic solvent vapors in nude mice in vivo. Ind Health 27:37-47. Ungvary G, Tatrai E. 1985. On the embryotoxic effects of benzene and its alkyl derivatives in mice, rats and rabbits. Arch Toxicol (Suppl)8:425-430. (As cited in ATSDR 2000.)
von Euler G, Fuxe K, Hansson T, et al. 1989. Persistent effects of neonatal toluene exposure on regional brain catecholamine levels and turnover in the adult male rat. Toxicology 54:1-16. (As cited in ATSDR 2000.)
von Euler G, Ogren S-O, Eneroth P, et al. 1994. Persistent effects of 80 ppm toluene on dopamineregulated locomotor activity and prolactin secretion in the male rat. Neurotoxicology 15(3):621-4. (As cited in ATSDR 2000.)
von Euler G, Ogren S-O, Li XM, et al. 1993. Persistent effects of subchronic toluene exposure on spatial learning and memory, dopamine-mediated locomotor activity and dopamine D2 against binding in the rat. Toxicology 77:223-232. (As cited in ATSDR 2000.)
von Oettingen WF, Neal PA, Donahue DD, et al. 1942. The toxicity and potential dangers of toluene with special reference to its maximal permissible concentration. U.S. Public Health Service Publication Health Bull No. 279:50. (As cited in ATSDR 2000.)
Vrca A, Bozicevic D, Bozikov V, et al. 1997a. Brain stem evoked potentials and visual evoked potentials in relation to the length of occupational exposure to low levels of toluene. Acta Medica Croatica 51:215-219. (As cited in ATSDR 2000.)
Vrca A, Bozicevic D, Karacic V, et al. 1995. Visual evoked potentials in individuals exposed to longterm low concentrations of toluene. Arch Toxicol 69(5):337-40. (As cited in ATSDR 2000.)
Vrca A, Karacic V, Bozicevic D, et al. 1997b. Cognitive evoked potentials VEP P300 in persons occupationally exposed to low concentrations of toluene. Arh Hig Rada Toksikol 48: 277-285. (As cited in ATSDR 2000.)
Walker JT, Bloom TF, Stern FB, et al. 1993. Mortality of workers employed in shoe manufacturing. Scand J Work Environ Health 19:89-95. (As cited in ATSDR 2000.)
Wood RW, Rees DC, Laties VG. 1983. Behavioral effects of toluene are modulated by stimulus control. Toxicol Appl Pharmacol 68:462-472. (As cited in ATSDR 2000.)
Yin S, Li G, Hu Y, et al. 1987. Symptoms and signs of workers exposed to benzene, toluene or the combination. Ind Health 25:113-130.
Zavalic M, Mandic Z, Turk R, et al. 1998a. Assessment of colour vision impairment in male workers exposed to toluene generally above occupational exposure limits. Occup Med 48(3):175-180. (As cited in ATSDR 2000.)
Zavalic M, Mandic Z, Turk R, et al. 1998b. Qualitative assessment of color vision impairment in workers exposed to toluene. Am J Ind Med 33(3): 297-304. (As cited in ATSDR 2000.)
Zavalic M, Mandic Z, Turk R, et al. 1998c. Qualitative color vision impairment in toluene-exposed workers. Int Arch Occup Environ Health 71:194-200. (As cited in ATSDR 2000.)
Fermer la fenêtre pour retourner à la page précédente